Въпросът какво е електролиза се разглежда в училищния курс по физика и за повечето хора не е тайна. Друго нещо е неговата важност и практическо приложение. Този процес се използва с голяма полза в различни индустрии и може да бъде полезен за домашния майстор.
Съдържание
- 1 Какво е електролиза?
- 2 Законите за електролизата на Фарадей
- 3 Електролиза на стопилка
- 4 Характеристики на електролизата в разтвори
- 5 Електролиза в газове
- 6 Характеристики на процесите, протичащи на катода и анода
- 7 Фактори, влияещи върху процеса на електролиза
- 8 Къде се използва електролизата?
- 9 Разходи за енергия
Какво е електролиза?
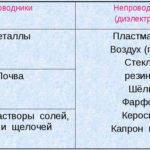
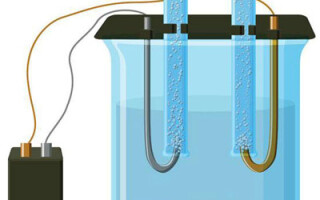
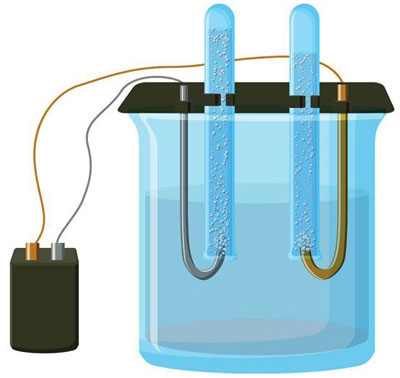
Електролизата е комплекс от специфични процеси в системата от електроди и електролит, когато през нея протича постоянен електрически ток. Механизмът му се основава на възникването на йонен ток. Електролитът е проводник тип 2 (йонна проводимост), при което настъпва електролитна дисоциация. Свързва се с разлагане на йони с положителни (катион) и отрицателен (анион) зареждане.
Електролизната система задължително съдържа положителен (анод) и отрицателен (катод) електрод. При подаване на постоянен електрически ток катиони започват да се движат към катода, а аниони - към анода. Катионите са основно метални йони и водород, а анионите са кислород, хлор. На катода катионите прикрепват излишните електрони към себе си, което осигурява настъпване на редукционната реакция Men+ + ne → Me (където n е валентността на метала). На анода, напротив, от аниона се дарява електрон с протичаща окислителна реакция.
Така в системата се осигурява редокс процес. Важно е да се има предвид, че за протичането му е необходима подходяща енергия. Тя трябва да бъде осигурена от външен източник на ток.
Законите за електролизата на Фарадей
Великият физик М. Фарадей със своите изследвания направи възможно не само да се разбере природата на електролизата, но и да се направят необходимите изчисления за нейното осъществяване. През 1832 г. се появяват неговите закони, свързващи основните параметри на протичащите процеси.
Първи закон
Първият закон на Фарадей гласи, че масата на веществото, което се намалява на анода, е право пропорционална на електрическия заряд, индуциран в електролита: m = kq = k*I*t, където q е зарядът, k е коефициентът или електрохимичният еквивалент на веществото, I е силата на тока, протичащ през електролита, t е времето за преминаване на тока.

Втори закон
Вторият закон на Фарадей направи възможно определянето на коефициента на пропорционалност k. Звучи така: електрохимичният еквивалент на всяко вещество е право пропорционален на неговата моларна маса и обратно пропорционален на валентността. Законът се изразява като:

k = 1/F*A/z, където F е константата на Фарадей, A е моларната маса на веществото, z е неговата химическа валентност.
Като се вземат предвид и двата закона, е възможно да се изведе окончателната формула за изчисляване на масата, отложена върху електрода на веществото: m = A*I*t/(n*F), където n е броят на електроните, участващи в електролизата. Обикновено n съответства на заряда на йона. От практическа гледна точка връзката между масата на веществото и приложения ток е важна, което дава възможност да се контролира процесът чрез промяна на силата му.
Електролиза на стопилка
Една от възможностите за електролиза е използването на стопилка като електролит. В този случай в процеса на електролиза участват само стопени йони. Класически пример е електролизата на разтопена сол NaCl (сол). Отрицателните йони се втурват към анода, което означава, че се отделя газ (Cl). На катода ще настъпи редукция на метала, т.е. отлагане на чист Na, образуван от положителни йони, които са привлекли излишните електрони. Други метали могат да бъдат получени по подобен начин (K, Ca, Li и др.) от клането на съответните соли.
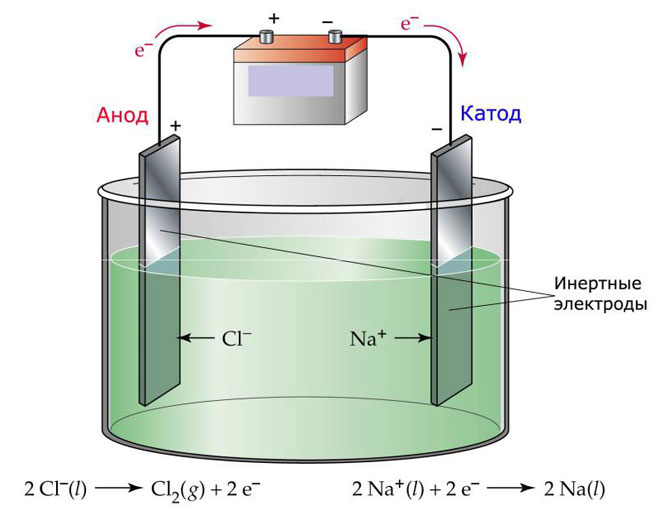
По време на електролизата в стопилка, електродите не се разтварят, а участват само като източник на ток. При производството им можете да използвате метал, графит, някои полупроводници. Важно е материалът да има достатъчна проводимост. Един от най-разпространените материали е медта.
Характеристики на електролизата в разтвори
Електролизата във воден разтвор се различава значително от стопилката. Тук протичат три конкуриращи се процеса: окисление на вода с отделяне на кислород, анионно окисление и анодно разтваряне на метала. В процеса участват йоните на водата, електролита и анода.Съответно, на катода може да настъпи редукция на водород, електролитни катиони и аноден метал.

Възможността за възникване на тези конкурентни процеси зависи от големината на електрическите потенциали на системата. Ще продължи само процесът, който изисква по-малко външна енергия. Следователно катиони с максимален електроден потенциал ще бъдат редуцирани на катода, а аниони с най-нисък потенциал ще бъдат окислени на анода. Електродният потенциал на водорода се приема за "0". Например, за калий е (-2,93V), натрий - (-2,71V), водя (-0,13V), докато среброто има (+0,8 V).
Електролиза в газове
Газът може да играе ролята на електролит само в присъствието на йонизатор. В този случай токът, преминаващ през йонизираната среда, предизвиква необходимия процес върху електродите. Законите на Фарадей обаче не важат за газовата електролиза. За неговото изпълнение са необходими следните условия:
- Без изкуствена йонизация на газа, нито високото напрежение, нито високият ток няма да помогнат.
- За електролиза са подходящи само киселини, които не съдържат кислород и са в газообразно състояние, а някои газове.
Важно! Когато са изпълнени необходимите условия, процесът протича подобно на електролизата в течен електролит.
Характеристики на процесите, протичащи на катода и анода
За практическото приложение на електролизата е важно да се разбере какво се случва на двата електрода, когато се приложи електрически ток. Типичните процеси са:
- катод. Към него се втурват положително заредени йони. Тук се извършва редукция на метали или отделяне на водород. Има няколко категории метали според катионната активност.Метали като Li, K, Ba, St, Ca, Na, Mg, Be, Al се редуцират добре само от разтопени соли. Ако се използва разтвор, тогава се отделя водород поради електролизата на водата. Възможно е да се постигне редукция в разтвор, но при достатъчна концентрация на катиони, за следните метали - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесът протича най-лесно за Ag, Cu, Bi, Pt, Au, Hg.
- анод. Отрицателно заредените йони влизат в този електрод. Окислени, те поемат електрони от метала, което води до анодното им разтваряне, т.е. преход в положително заредени йони, които се изпращат към катода. Анионите също се класифицират според тяхната активност. Такива аниони PO4, CO3, SO4, NO3, NO2, ClO4, F могат да се изхвърлят само от стопилки.Във водните разтвори не те се подлагат на електролиза, а водата с отделяне на кислород. Най-лесно реагират аниони като OH, Cl, I, S, Br.

При осигуряване на електролиза е важно да се вземе предвид склонността на материала на електрода да се окислява. В това отношение се открояват инертните и активните аноди. Инертните електроди са изработени от графит, въглерод или платина и не участват в подаването на йони.
Фактори, влияещи върху процеса на електролиза
Процесът на електролиза зависи от следните фактори:
- Състав на електролита. Различни примеси имат значителен ефект. Те са разделени на 3 вида – катиони, аниони и органични. Веществата могат да бъдат повече или по-малко отрицателни от основния метал, което пречи на процеса. Сред органичните примеси се открояват замърсителите (напр. масла) и повърхностноактивните вещества. Тяхната концентрация има максимално допустими стойности.
- плътност на тока. В съответствие със законите на Фарадей, масата на отложеното вещество се увеличава с увеличаване на силата на тока. Възникват обаче неблагоприятни обстоятелства - концентрирана поляризация, повишено напрежение, интензивно нагряване на електролита. Имайки това предвид, има оптимални стойности на плътността на тока за всеки конкретен случай.
- рН на електролита. Киселинността на околната среда също се избира, като се вземат предвид металите. Например, оптималната стойност на киселинността на електролита за цинк е 140 g/cu.dm.
- Температура на електролита. Има двусмислен ефект. С повишаване на температурата скоростта на електролизата се увеличава, но активността на примесите също се увеличава. Има оптимална температура за всеки процес. Обикновено тя е в диапазона от 38-45 градуса.
Важно! Електролизата може да се ускори или забави от различни влияния и избор на електролитен състав. Всяко приложение има собствен режим, който трябва да се спазва стриктно.
Къде се използва електролизата?
Електролизата се използва в много области. Има няколко основни области на използване за получаване на практически резултати.
Галванопластика
Тънко, издръжливо метално покритие може да се нанесе чрез електролиза. Продуктът, който ще бъде покрит, се монтира във ваната под формата на катод, а електролитът съдържа сол на желания метал. Така че можете да покриете стоманата с цинк, хром или калай.

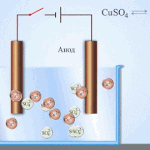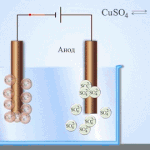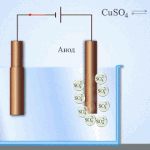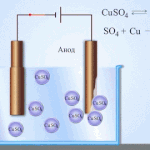
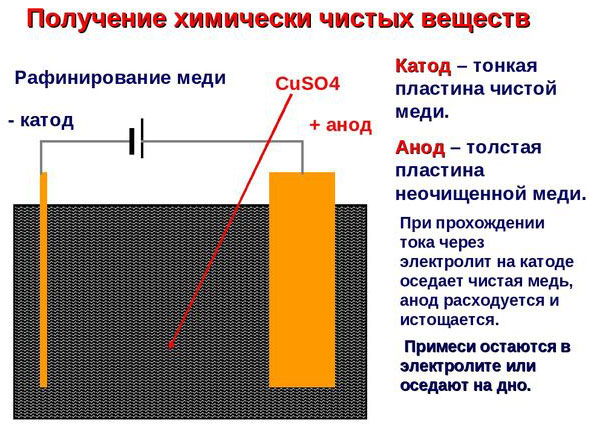
Електрорафиниране - рафиниране на мед
Пример за електрическо почистване може да бъде следната опция: катод - чиста мед анод - мед с примеси, електролит - воден разтвор на меден сулфат. Медта от анода преминава в йони и се утаява в катода вече без примеси.
Добив на метал
За да се получат метали от соли, те се прехвърлят в стопилката и след това се осигурява електролиза в нея. Такъв метод е доста ефективен за получаване на алуминий от боксити, натрий и калий.

Анодиране
При този процес покритието е направено от неметални съединения. Класически пример е анодирането на алуминий. Алуминиевата част е монтирана като анод. Електролитът е разтвор на сярна киселина. В резултат на електролизата върху анода се отлага слой от алуминиев оксид, който има защитни и декоративни свойства. Тези технологии се използват широко в различни индустрии. Можете да извършвате процесите със собствените си ръце в съответствие с правилата за безопасност.
Разходи за енергия
Електролизата изисква високи разходи за енергия. Процесът ще бъде от практическа стойност, ако анодният ток е достатъчен и за това е необходимо да се приложи значителен постоянен ток от източника на енергия. Освен това, когато се извършва, възникват странични загуби на напрежение - пренапрежение на анода и катода, загуби в електролита поради неговото съпротивление. Ефективността на инсталацията се определя чрез съотнасяне на мощността на потреблението на енергия към единица полезна маса на полученото вещество.
Електролизата се използва в индустрията от дълго време и с висока ефективност. Анодизираните и галванични покрития са станали нещо обичайно в ежедневието, а добивът и обогатяването на материали помагат за извличането на много метали от рудата. Процесът може да бъде планиран и изчислен, като се знаят основните му закономерности.
Подобни статии: