Често има проблем да се определи кой от електродите е катод и кой анод. Първо трябва да разберете условията.
Съдържание
Концепцията за катод и анод - просто обяснение
В сложните вещества електроните са разпределени неравномерно между атомите в съединенията. В резултат на взаимодействието частиците се движат от атом на едно вещество към атом на друго. Реакцията се нарича редокс. Загубата на електрони се нарича окисление, а елементът, който дарява електрони, се нарича редуциращ агент.
Добавянето на електрони се нарича редукция, приемащият елемент в този процес е окислителят. Прехвърлянето на електрони от редуктор към окислител може да протече през външна верига и след това може да се използва като източник на електрическа енергия.Устройствата, в които енергията на химическата реакция се превръща в електрическа енергия, се наричат галванични елементи.
Най-простият класически пример за галванична клетка е две пластини, изработени от различни метали и потопени в електролитен разтвор. В такава система окисляването настъпва на един метал, а редукция на друг.
ВАЖНО! Електродът, при който настъпва окисляване, се нарича анод. Електродът, върху който се извършва редукцията, е катодът.
От училищните учебници по химия е известен пример за медно-цинкова галванична клетка, която работи благодарение на енергията на реакцията между цинк и меден сулфат. В устройството Jacobi-Daniel медна плоча се поставя в разтвор на меден сулфат (меден електрод), цинкова плоча се потапя в разтвор на цинков сулфат (цинков електрод). Цинковият електрод отделя катиони в разтвора, създавайки излишен положителен заряд в него, а при медния електрод разтворът се изчерпва с катиони, тук разтворът е отрицателно зареден.
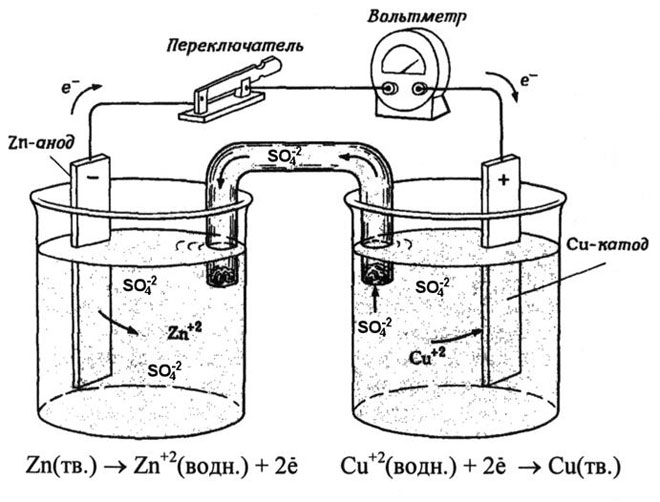
Затварянето на външната верига кара електроните да текат от цинковия електрод към медния електрод. Равновесните отношения на фазовите граници се прекъсват. Провежда се окислително-редукционна реакция.
Енергията на спонтанна химическа реакция се превръща в електрическа енергия.
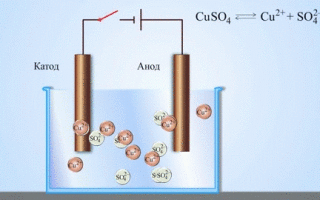
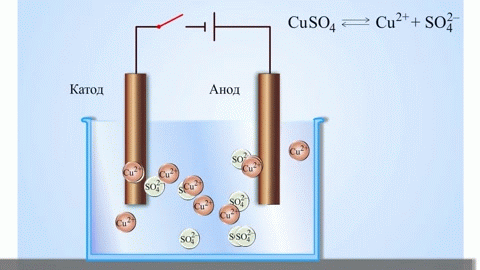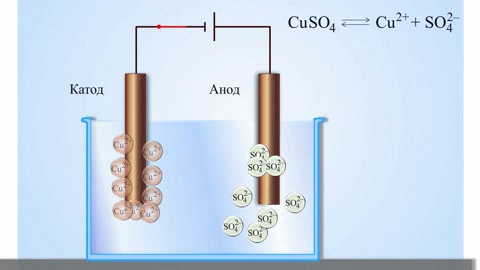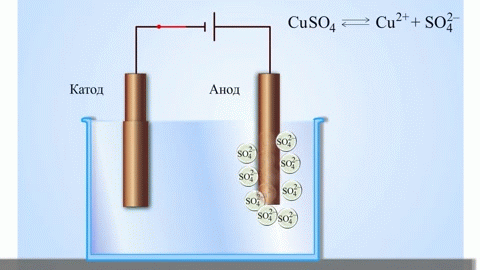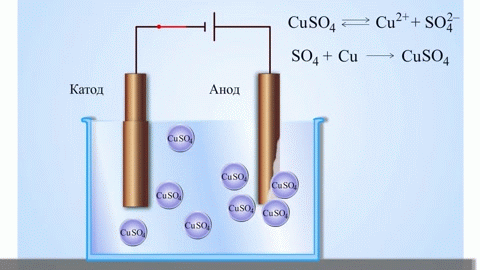
Ако химическа реакция се провокира от външна енергия на електрически ток, протича процес, наречен електролиза. Процесите, протичащи по време на електролизата, са обратни на процесите, протичащи по време на работата на галваничния елемент.
ВНИМАНИЕ! Електродът, където се извършва редукцията, се нарича още катод, но при електролизата той е отрицателно зареден, докато анодът е положителен.
Приложение в електрохимията
Анодите и катодите участват в много химични реакции:
- електролиза;
- Електроекстракция;
- галванопластика;
- Електротип.
Металите се получават чрез електролиза на стопени съединения и водни разтвори, металите се пречистват от примеси и се извличат ценни компоненти (електролитно рафиниране). Пластините се отливат от метала, който се почиства. Те се поставят като аноди в електролизатора. Под въздействието на електрически ток металът се разтваря. Неговите катиони преминават в разтвор и се изхвърлят на катода, образувайки утайка от чист метал. Примесите, съдържащи се в оригиналната непочистена метална плоча, или остават неразтворими като анодна утайка, или преминават в електролита, където се отстраняват. Мед, никел, олово, злато, сребро, калай се подлагат на електролитно рафиниране.
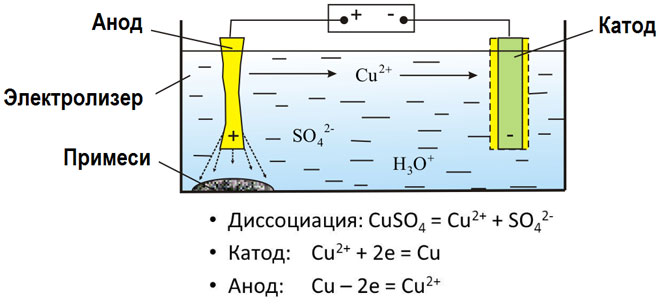
Електроекстракцията е процес на отделяне на метал от разтвор по време на електролиза. За да може металът да влезе в разтвор, той се обработва със специални реактиви. По време на процеса на катода се утаява метал с висока чистота. Така се получава цинк, мед, кадмий.
За да се избегне корозия, да се даде здравина, да се украси продукта, повърхността на един метал е покрита със слой от друг. Този процес се нарича галванично покритие.

Галваничното покритие е процесът на получаване на метални копия от насипни предмети чрез метално електроотлагане.

Приложение във вакуумни електронни устройства
Принципът на действие на катода и анода във вакуумно устройство може да бъде демонстриран с електронна лампа.Прилича на херметически затворен съд с метални части вътре. Устройството се използва за коригиране, генериране и преобразуване на електрически сигнали. Според броя на електродите биват:
- диоди;
- триоди;
- тетроди;
- пентоди и др.
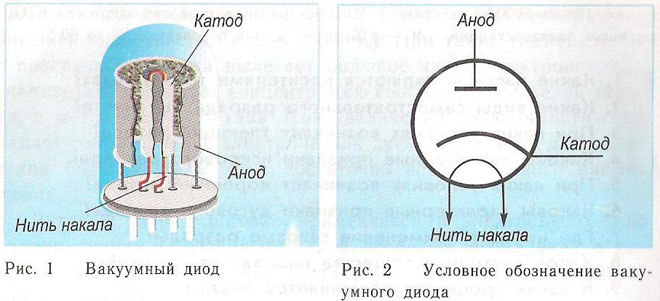
Диодът е вакуумно устройство с два електрода, катод и анод. Катодът е свързан към отрицателния полюс на източника на захранване, анодът - към положителния. Целта на катода е да излъчва електрони при нагряване с електрически ток до определена температура. Излъчените електрони създават пространствен заряд между катода и анода. Най-бързите електрони се втурват към анода, преодолявайки отрицателната потенциална бариера на пространствения заряд. Анодът приема тези частици. Във външната верига се създава аноден ток. Електронният поток се управлява от допълнителни електроди чрез прилагане на електрически потенциал към тях. С помощта на диоди променливият ток се превръща в постоянен.
Приложение в електрониката
Днес се използват полупроводникови видове диоди.
В електрониката широко се използва свойството на диодите да пропускат ток в посока напред и да не преминават в обратна посока.
Работата на светодиода се основава на свойството на полупроводниковите кристали да светят, когато ток преминава през p-n прехода в посока напред.
Галванични източници на постоянен ток - батерии
Химическите източници на електрически ток, при които протичат обратими реакции, се наричат батерии: те се презареждат и се използват многократно.

По време на работа на оловна батерия възниква редокс реакция.Металното олово окислява, дарява своите електрони, редуцирайки оловния диоксид, който приема електрони. Оловният метал в батерията е анодът и е отрицателно зареден. Оловният диоксид е катод и е положително зареден.
При разреждането на батерията се изразходват веществата на катода и анода и техния електролит, сярна киселина. За зареждане на батерията тя е свързана към източник на ток (плюс към плюс, минус към минус). Посоката на тока сега е обратна на това, което е било, когато батерията е била разредена. Електрохимичните процеси върху електродите са "обратни". Сега оловният електрод става катод, процесът на редукция се извършва върху него, а оловният диоксид става анод, като се извършва процедурата на окисляване. Батерията пресъздава необходимите за нейната работа вещества.
Защо има объркване?
Проблемът възниква от факта, че определен знак за заряд не може да бъде здраво закрепен към анода или катода. Често катодът е положително зареден електрод, а анодът е отрицателен. Често, но не винаги. Всичко зависи от процеса, протичащ върху електрода.
ВНИМАНИЕ! Частта, която е поставена в електролита, може да бъде както анод, така и катод. Всичко зависи от целта на процеса: трябва да поставите друг слой метал върху него или да го премахнете.
Как да идентифицираме анода и катода
В електрохимията анодът е електродът, на който протичат окислителни процеси, катодът е електродът, където настъпва редукция.
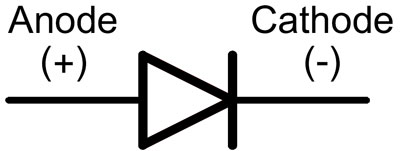
В диода крановете се наричат анод и катод. Токът ще тече през диода, ако анодният кран е свързан към "плюса", "катодният" кран - към "минуса".
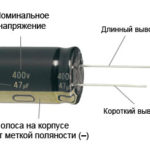
За нов светодиод с неизрязани контакти анодът и катодът се определят визуално по дължина. Катодът е по-къс.

Ако контактите са прекъснати, батерия, прикрепена към тях, ще помогне. Светлината ще се появи, когато полярностите съвпаднат.
Анод и катоден знак
В електрохимията е по-правилно да се говори не за знаците на зарядите на електродите, а за процесите, протичащи в тях. Реакцията на редукция протича на катода, а реакцията на окисление протича на анода.
В електротехниката, за протичането на тока, катодът е свързан към отрицателния полюс на източника на ток, анода към положителния.
Подобни статии: